大家好,今天小编关注到一个比较有意思的话题,就是关于医药项目审批原则的问题,于是小编就整理了3个相关介绍的解答,让我们一起看看吧。
医疗机构配制制剂须经哪些部门批准?
医疗机构配制制剂需要经过以下部门的批准:

1. 国家食品药品监督管理总局(即国家药监局):作为中国的药品监管机构,国家药监局负责医疗机构配制制剂的审批和监管。医疗机构需要向国家药监局递交相应的材料和申请,经过审核和审批后才能获得批准。
2. 医疗机构管理部门:根据国家相关规定,各地区的医疗机构管理部门也会对医疗机构配制制剂进行审批。医疗机构需要向所在地区的医疗机构管理部门递交申请,并提供相关的证明材料和申请表格,经过审核和审批后才能获得批准。
3. 医疗机构自身内部:医疗机构在进行配制制剂前,也需要经过自身内部的审批程序。一般来说,医疗机构需要设立相应的药剂科室,并由具备相关专业知识和技能的人员进行配制制剂工作。医疗机构内部的药剂科室会对配制的制剂进行质量控制和监督。

需要注意的是,在具体操作中,根据不同地区和各种药品的特殊性,可能还需要经过其他相关部门的审批和监管,例如药品监管部门、卫生部门等。
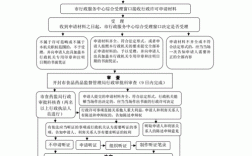
医疗机构制剂许可证由所在地省、自治区、直辖市人民政府药品监督管理部门审批。经过批准后,才能取得医疗机构制剂许可证。医疗机构制剂许可证会标明有效期,到期需要重新审查发证。
医疗机构配制制剂,必须取得医疗机构制剂许可证,否则属于违法行为。
没有医疗机构制剂许可证,但医疗机构生产、销售药品的,责令关闭,没收生产、销售的药品和违法所得,并处生产、销售的药品货值金额15倍以上30倍以下的罚款。如果货值金额不足10万元的,按10万元计算。
药品组批原则是什么意思?
药品组批原则是指在药品生产和销售过程中,为了保证药品质量和安全,对药品进行分类管理和批次控制的原则。具体来说,药品组批原则包括以下几个方面:

药品分类管理:根据药品的性质、用途、剂型等特点,将药品分为不同的类别进行管理,以便于对不同类别的药品进行不同的监管和控制。
批次控制:对每一批次的药品进行严格的质量控制和监管,确保每一批次的药品都符合规定的质量标准和安全要求。
药品追溯:对每一批次的药品进行追溯,以便于在发生质量问题时能够及时找到问题所在,并采取相应的措施进行处理。
药品标识:对每一批次的药品进行标识,以便于在生产、销售和使用过程中能够准确地识别和管理。
总之,药品组批原则是为了保证药品质量和安全而制定的一系列管理和控制措施,是药品生产和销售过程中必须遵守的重要原则。
药品组批原则是指根据药品的药理特点、适应症、毒副作用等因素,将相同药物成分的不同制剂(如不同厂家生产的同一种药品)进行筛选和比较,选出最合适的药品,然后进行统一采购,以达到节约药品费用,提高药品质量和安全的目的。药品组批原则在医疗机构的药品采购管理中非常重要,可以减少药品浪费和重复使用,提高医疗质量和效益。
新药上市审批流程和时间?
1、申请企业应当按照《中华人民共和国药品管理法》和有关法律、法规,按照《新药上市审批申请书》的要求,准备好相关文件,提出上市审批申请。
2、国家食品药品监督管理总局药品审评中心收到申请企业提交的上市审批申请材料后,对所提交的文件进行审查,确定所提交的文件是否符合上市审批条件。
新药从申报到获批需165~185个工作日。
到此,以上就是小编对于医药项目审批原则是什么的问题就介绍到这了,希望介绍的3点解答对大家有用。

 微信扫一扫打赏
微信扫一扫打赏









 渝ICP备2023004149号-17
渝ICP备2023004149号-17